เป็นที่ทราบกันมานานแล้วว่าโมเลกุลทั้งหมดมีประจุเท่ากันและตรงข้ามสองค่าซึ่งถูกแยกด้วยระยะห่าง ในกรณีของโมเลกุลขั้วโลกนั้นจุดศูนย์กลางประจุลบไม่ตรงกับจุดศูนย์กลางประจุบวก ขอบเขตของขั้วในโมเลกุลโควาเลนต์ดังกล่าวสามารถอธิบายได้ด้วยคำว่า Dipole Moment ซึ่งโดยพื้นฐานแล้วเป็นการวัดค่าของขั้วในพันธะโควาเลนต์เชิงขั้ว
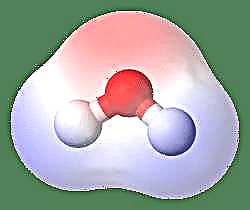
ตัวอย่างที่ง่ายที่สุดของไดโพลคือโมเลกุลของน้ำ โมเลกุลของน้ำมีขั้วเนื่องจากการแบ่งปันอิเล็กตรอนไม่เท่ากันในโครงสร้าง "งอ" โมเลกุลของน้ำก่อตัวเป็นมุมโดยมีอะตอมไฮโดรเจนที่ปลายและออกซิเจนที่จุดยอด เนื่องจากออกซิเจนมีอิเลคโตรเนกาติวีตี้สูงกว่าไฮโดรเจนด้านข้างของโมเลกุลที่มีอะตอมออกซิเจนจึงมีประจุลบบางส่วนในขณะที่ไฮโดรเจนที่อยู่ตรงกลางมีประจุเป็นบวกบางส่วน ด้วยเหตุนี้ทิศทางของโมเมนต์ไดโพลจึงชี้ไปที่ออกซิเจน
ในภาษาของฟิสิกส์โมเมนต์ไดโพลไฟฟ้าคือการวัดการแยกของประจุไฟฟ้าบวกและลบในระบบประจุนั่นคือการวัดของขั้วรวมของระบบประจุ - นั่นคือการแยกประจุไฟฟ้าโมเลกุลซึ่ง นำไปสู่ไดโพล ในทางคณิตศาสตร์และในกรณีง่าย ๆ ของการประจุสองจุดหนึ่งอันที่มีประจุ + q และอีกอันที่มีประจุ? q, ไดโพลโมเมนต์ไฟฟ้า p สามารถแสดงเป็น: p = qd โดยที่ d คือเวกเตอร์การกระจัดที่ชี้จากประจุลบไป ประจุบวก ดังนั้นเวกเตอร์ไดโพลโมเมนต์ไฟฟ้า p ชี้จากประจุลบเป็นประจุบวก
อีกวิธีในการดูมันคือการแสดงช่วงเวลาของไดโพลด้วยตัวอักษรกรีก m, m = ed โดยที่ e คือประจุไฟฟ้าและ d คือระยะทางของการแยก มันถูกแสดงในหน่วยของ Debye และเขียนเป็น D (โดยที่ 1 Debye = 1 x 10-18e.s.u cm) โมเมนต์ไดโพลคือปริมาณเวกเตอร์และแสดงด้วยลูกศรขนาดเล็กที่มีหางที่กึ่งกลางเชิงบวกและหัวชี้ไปทางศูนย์ลบ ในกรณีของโมเลกุลน้ำช่วงเวลาไดโพลคือ 1.85 D ในขณะที่โมเลกุลของกรดไฮโดรคลอริกคือ 1.03 D และสามารถแทนได้เป็น:
เราได้เขียนบทความมากมายเกี่ยวกับช่วงเวลาไดโพลสำหรับนิตยสารอวกาศ นี่คือบทความเกี่ยวกับสิ่งที่ทำจากน้ำและนี่เป็นบทความเกี่ยวกับโมเลกุล
หากคุณต้องการข้อมูลเพิ่มเติมเกี่ยวกับช่วงเวลาไดโพลลองดูบทความเหล่านี้จาก Hyperphysics และ Science Daily
นอกจากนี้เรายังได้บันทึกเรื่องราวทั้งหมดของ Astronomy Cast เกี่ยวกับโมเลกุลในอวกาศ ฟังที่นี่ตอนที่ 116: โมเลกุลในอวกาศ
แหล่งที่มา:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule